Derajat Disosiasi Elektrolit Lemah

Contoh Pemecahan Masalah Menurunkan Suhu Beku Dan Meningkatkan Titik Didih Solusi Hukum Kedua Raul
domo-print.ru
Reaksi ionisasi basa lemah juga merupakan reaksi kesetimbangan dimana tetapan kesetimbangan untuk reaksi ini adalah tetapan ionisasi basa kb yang juga disebut tetapan disosiasi basa dengan rumus.

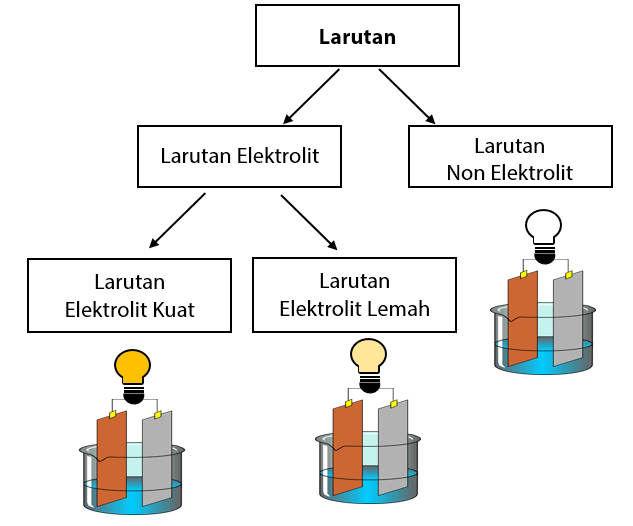
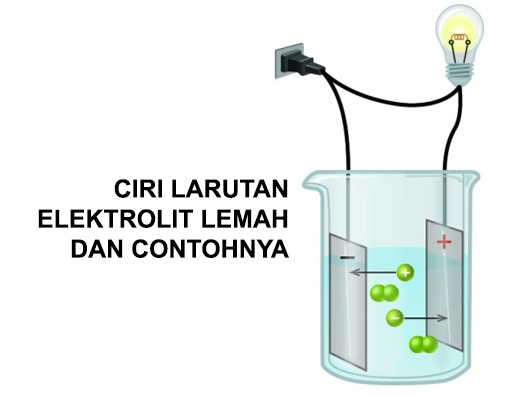
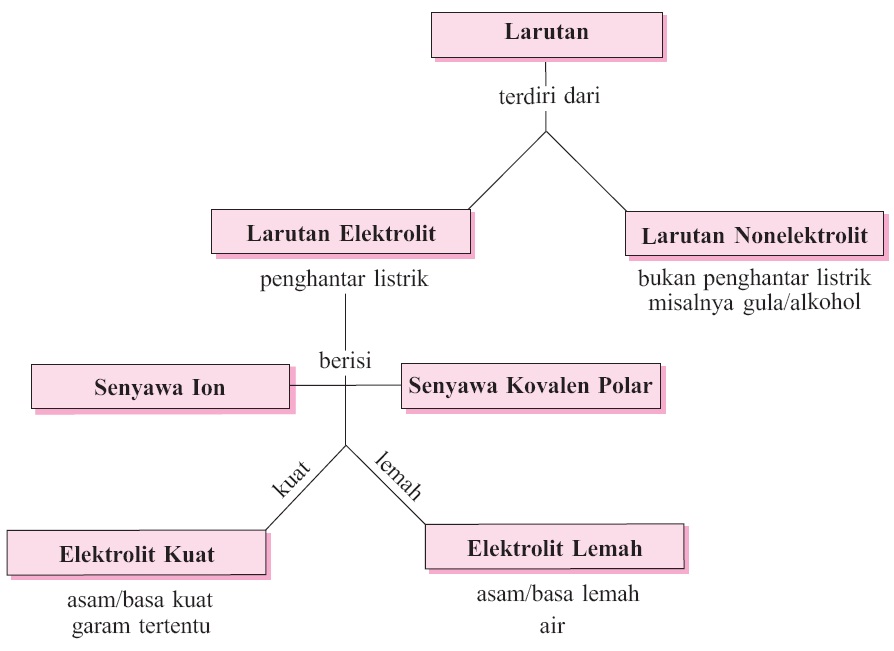
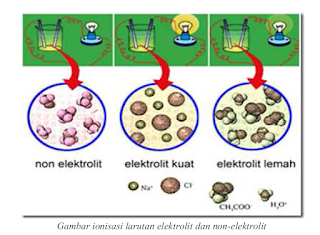
Derajat disosiasi elektrolit lemah. Golongan elektrolit lemah adalah zat yang memiliki derajat disosiasi antara 0 a 1 dan apabila dilarutkan dalam air hanya terurai sebagian. Disosiasi elektrolit adalah reaksi ketika suatu elektrolit terpecah terdisosiasi menjadi ion ion pembentuknya. Kb tetapakn disosiasi basa.
C konsentrasi basa. Fraksi dari jumlah total molekul yang ada dalam larutan sebagai ion dikenal sebagai tingkat ionisasi atau derajat disosiasi. Asal sobat tahu untuk menentukan kuat tidaknya suatu larutan tergantung dari kemampuan ionisasi dari senyawa elektrolit yang diilarutkan dalam pelarut.
Salah satu contoh asam lemah adalah c h 3 cooh. Selanjutnya bagaimanakah menentukan ph asam elektrolit lemah. Suatu asam atau basa yang merupakan suatu elektrolit kuat disebut asam atau basa kuat.
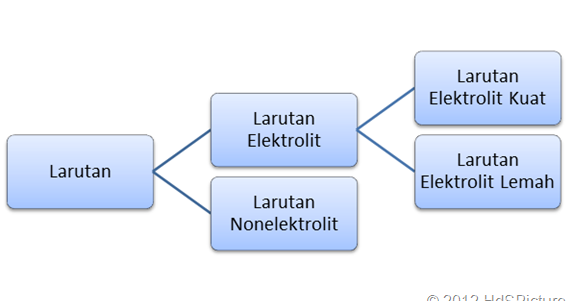
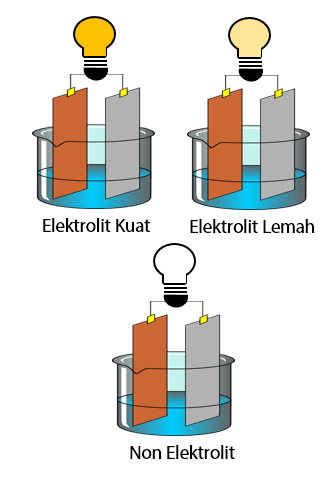
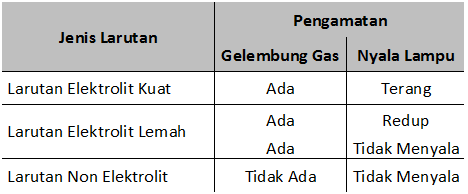
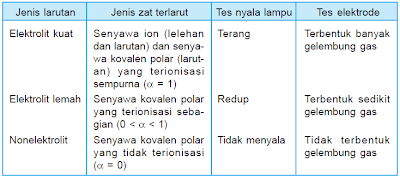
Elektrolit kuat a 1 elektrolit lemah 0 a 1 dan non elektrolit a 0. Dengan nilai a untuk. Tingkat ini dapat diwakili oleh simbol a.
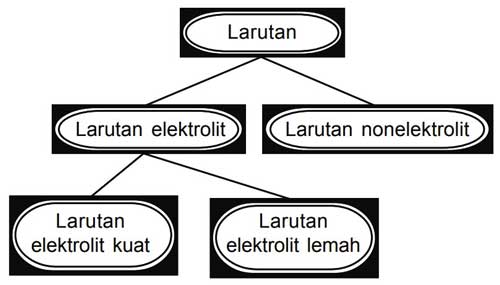
A akar kb c. A derajat disosiasi basa. Derajat ionisasi dan kekuatan elektrolit sebelumnya kita telah belajar tentang larutan elektrolit dan nonelektrolitlarutan elektrolit sendiri ada yang elektrolit kuat dan ada juga yang lemah.
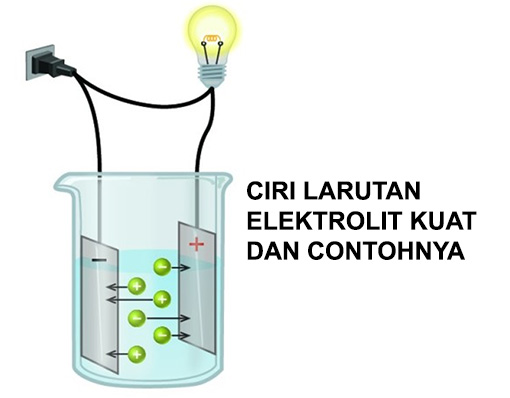
Telah diamati bahwa semua elektrolit tidak terionisasi pada tingkat yang sama. Natrium klorida suatu senyawa ionik membentuk ion na dan cl pada saat dilarutkan di dalam air. Ion ion tersebut mempunyai gaya elektrostatik yang kuat.